Gli studi sui gemelli identici sono da sempre fondamentali per capire la natura delle malattie complesse, ovvero malattie dovute sia ad una componente genetica sia a fattori ambientali.
Gli studi sui gemelli identici sono da sempre fondamentali per capire la natura delle malattie complesse, ovvero malattie dovute sia ad una componente genetica sia a fattori ambientali.
Particolarmente interessanti sono le coppie di gemelli identici discordanti per malattia (un gemello è malato, l’altro è sano).
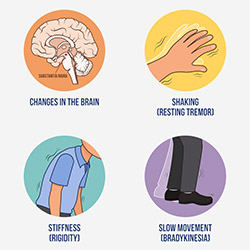
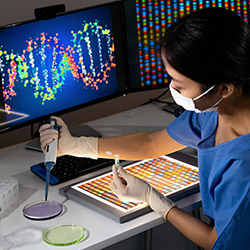
Questi gemelli condividono il 100% del DNA, cioè il materiale genetico che determina il colore degli occhi, dei capelli, e anche le malattie alle quali sono predisposti. E infatti, i gemelli identici si somigliano molto fisicamente, ed in teoria dovrebbero soffrire anche delle stesse malattie ereditarie: quindi, quando discordanti per una malattia genetica (quando sono “gemelli diversi’), studiarli ci può aiutare a capire meglio cosa favorisce l’insorgenza della malattia stessa. Il Parkinson è una malattia a predisposizione genetica, e grazie all’enorme sforzo profuso dalla Fondazione Grigioni e dal Centro Parkinson del CTO-Pini abbiamo raccolto negli anni 42 coppie di gemelli identici discordanti per la malattia di Parkinson. Sul DNA estratto dal sangue di questi gemelli diversi abbiamo quindi effettuato il sequeziamento ultramassivo dell’intero genoma, un termine complicato per indicare che è stata determinata la sequenza di tutti i “mattoncini’ che formano il DNA di ciascuno di noi. Lo sforzo è di enorme portata, considerato che il nostro DNA è costituito da ben 6 miliardi di mattoncini (3 miliardi ereditati per via materna, e 3 miliardi per via paterna). Per avere una idea di quanto enorme sia la mole di dati ottenuta, basti pensare che per contare da 1 a 3 miliardi senza mai fermarsi impiegheremmo qualcosa come 34.700 giorni (corrispondenti a 95 anni!). E non solo questo: ciascun gemello è stato sequenziato mediamente almeno 30 volte, raccogliendo complessivamente per tutti i gemelli analizzati qualcosa come 4000 miliardi di informazioni sui mattoncini di DNA.
E’ ora iniziata la sfida dell’analisi di questa mole di dati: per ognuno dei gemelli analizzati abbiamo identificato circa 6 milioni di varianti sul DNA, e tra queste, anche le mutazioni principali che determinano la malattia. Non tutte le varianti sono però condivise dalle coppie di gemelli: alcune non vengono ereditate dai genitori, ma possono insorgere per errore (per caso) durante la vita dell’individuo (si chiamano “varianti somatiche’). Infatti, le cellule che costituiscono il nostro organismo si dividono continuamente, e nel farlo duplicano il loro DNA: questo processo non è esente da errori, portando all’insorgenza casuale di varianti.
Un’ulteriore complicazione deriva dal fatto che varianti sul DNA possono anche essere indotte da fattori ambientali: si pensi ai danni che si possono avere se si è esposti ad agenti chimici o fisici tossici; il DNA è sensibile a questo tipo di esposizione, e ne può venir danneggiato. Quindi, per come insorgono nei diversi individui, queste varianti possono essere diverse anche fra coppie di gemelli, e potrebbero essere alla base delle differenze tra di loro. I nostri dati preliminari indicherebbero una differenza importante tra gemelli sani e gemelli malati relativamente al numero di queste “varianti somatiche’: i gemelli malati sembrano accumulare più varianti rispetto ai loro gemelli sani.
Un altro risultato interessante riguarda invece l’analisi specifica di pezzi di DNA chiamati “telomeri’. Questi si trovano alla fine dei cromosomi (il DNA, con i suoi 6 miliardi di mattoncini, è presente nel nucleo delle cellule in 46 diversi pezzetti, chiamati cromosomi). E’ noto che i telomeri si accorciano man mano durante la vita delle persone (telomeri corti sono tipici della terza età). I nostri dati sembrerebbero indicare una lunghezza media minore dei telomeri nei gemelli malati con una durata di malattia superiore ai 10 anni. Per il futuro vorremmo da un lato proseguire con l’analisi dei dati già raccolti, e dall’altro estendere queste analisi ad ampio spettro anche a tutte le persone che negli anni hanno donato il loro DNA alla Banca del Centro Parkinson (comprese le persone che soffrono di Parkinsonismi atipici). Questo è particolarmente importante nell’era della medicina personalizzata, perché l’identificazione delle mutazioni presenti nei singoli individui potrà essere fondamentale per dirigere la terapia, come nel caso dei soggetti portatori di mutazioni nel gene GBA, per il quale sono attualmente in corso una serie di trial clinici a loro dedicati.
Rosanna Asselta, Professore Ordinario di Genetica Medica, Humanitas University


 Gli studi sui gemelli identici sono da sempre fondamentali per capire la natura delle malattie complesse, ovvero malattie dovute sia ad una componente genetica sia a fattori ambientali.
Gli studi sui gemelli identici sono da sempre fondamentali per capire la natura delle malattie complesse, ovvero malattie dovute sia ad una componente genetica sia a fattori ambientali.